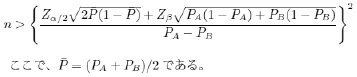免疫グロブリン超大量療法原因が不明である川崎病の治療に何を行うかは川崎病治療黎明期における大きな課題であった。1984年に古庄先生から免疫グロブリン400mg/kg×5日間投与とアスピリン30〜50mg/kgの併用がアスピリン単独治療に比べ有効であること、また1986年にDr Newburgerからも400mg/kg×4日間投与とアスピリン80〜100/kgの併用がアスピリン単独治療に比べ有効であることが相次いで報告された。これらの臨床試験により、1980年代は免疫グロブリン分割投与が川崎病初期治療として主流となった。その後1991年に再びDr Newburgerが免疫グロブリン 2g/kg単回療法が400mg/kg×4日間投与よりも優れた抗炎症作用があることを報告し、現在では日本国内でも広く2g/kgの免疫グロブリン超大量療法が広く行われるようになった。2g/kg単回の免疫グロブリン超大量療法を行うことによって川崎病最大の問題である冠動脈病変の合併頻度を5%程度まで下げることができたが、約2割の患者が免疫グロブリン超大量療法で解熱しない抵抗例であるため、これら免疫グロブリン抵抗例に対する治療戦略が現在の課題である。 冠動脈病変川崎病は全身性の血管炎が病気の本態であり、高い確率で心臓を栄養する冠動脈に後遺症を生じる。病理組織学的な報告によると、川崎病血管炎は発症後7〜8日目に始まり、ただちに動脈全周、全層の汎血管炎に至って動脈の既存構築は激しく破壊され、発症後2週間ほどで動脈拡張、動脈瘤が形成される。高度の炎症は1ヶ月ほど継続し、40病日頃に炎症細胞浸潤が消退する。急性期の炎症によって著しく傷害された動脈には、その瘢痕としての後遺症病変が長期にわたって残存する。特に8mm以上の巨大冠動脈瘤を合併した患者は冠動脈内の血流遅滞や内皮細胞障害による血栓形成、遠隔期の冠動脈瘢痕化による狭窄性病変の形成などによって狭心症や心筋梗塞を生じる可能性が高い事が知られている。 川崎病患者に対するステロイド投与川崎病治療黎明期である1970年代には川崎病血管炎に対する治療としてステロイド投与が広く行われていた。しかし1979年にプレドニゾロン投与が冠動脈病変合併を助長するといった後方視的検討が発表された以降、川崎病に対するステロイド投与は長らく禁忌とされてきた。免疫グロブリン療法の出現によって長らく表舞台から消えていたステロイド投与は、1990年代後半になって免疫グロブリン抵抗例に対する追加治療として、また初期治療としての効果を証明した臨床研究が明らかとなり、近年その有効性が再評価されつつある。しかし現時点では用法・用量・効果を含めた川崎病に対するステロイド投与の有用性を証明したエビデンスは存在しない。 リスクスコア免疫グロブリン超大量療法は8割以上の川崎病患者で有効な非常に優れた治療である。一方免疫グロブリン超大量療法が奏功しない2割の免疫グロブリン抵抗例が大部分の冠動脈病変を合併することは、免疫グロブリン抵抗例に対する治療戦略が極めて重要であることを物語っている。早期に血管炎を鎮静化させることが冠動脈のリモデリングを抑制して冠動脈病変発生頻度を減少させるといった理論的根拠から、免疫グロブリン抵抗例を治療開始前に予想できれば、より必要性が高い症例に限って強力な初期治療を行う治療戦略を行うことによって最小限のリスクで最大限の効果を得ることが可能となる。 ランダム化比較試験(無作為化比較試験)母集団内の対象を、通常、試験群と対照群、つまり実験的介入、治療処置、手技あるいは介入を受けるか受けないかの集団に無作為に割り付ける疫学的な実験。研究結果は、試験群と対照群との間の疾病および死亡、回復、その他の適切な帰結の率を厳密に比較することによって評価される。ランダム化比較試験は、疫学で利用できる科学的に最も厳密な仮説検証の方法とされている。 エンドポイント(※1)臨床試験において「エンドポイント」という言葉は、研究結果の「ものさし」あるいは「指標」の意味で用いられる。生存期間や奏功率などが主たるエンドポイントである。エンドポイントは、プライマリ・エンドポイントとセカンダリ・エンドポイントの2つに分けることが一般的である。プライマリ・エンドポイントとは、試験の主要な目的を測るためのエンドポイントであり、セカンダリ・エンドポイントは試験の二次的な目的を測るためのエンドポイントである。 マスク化(同義語:盲検化)研究遂行にあたって、研究参加者の行動や判断に影響を与えるようないくつかの事実や観察結果を、彼らに知らせないようにして伏せておくための方法。 PROBE法(※2)PROBEは、Prospective Randomized Open-labeled Blinded Endpointの略。盲検化をせずに、盲検化した試験と同等の結果信頼性を持つランダム化比較試験。エンドポイントの評価を、盲検化された効果判定委員会にゆだねることで、盲検化したランダム化比較試験と同等の信頼性を持つ。 サンプルサイズ決定(必要登録数の決定)研究を開始する前に、何人の対象者が必要かを数学的に決定する。考慮に入れる項目は、研究対象になる状態の罹患率または有病率、変量間に推定される関連性、望まれる検出力、許すことのできる第1種の過誤の大きさ。 ランダム割付(無作為割付)個人を複数の群(例えば、試験群と対照群)に、偶然に割り付けること。ランダム割付は、調査開始時に、試験群と対照群とを偶然変動の範囲内で類似させ、調査者の個人的な判断と偏見が割付に影響しないことを保証する。 最小化法(※3)Taves(※4)によって提唱された方法である。この方法は、患者を登録するたびに(最初の登録は完全無作為化する)、それぞれの層別因子ごとに症例数の均衡を図り、かつ、全体の症例数の均衡も図る方向に逐次的に割り付けていく方法である。この意味で、ランダム性は、少々犠牲にしてまでも、層別因子の均衡を登録時点で図りたいというデザインであり、また、事前に割り付け表を準備できず、コンピュータで制御する方法である。 サンプルサイズ計算(必要登録数)有意水準α、検出力1−β、実験群と対照群のエンドポイント発生率をそれぞれPA、PBとすると、一群のサンプルサイズnは、以下の式(※5)で計算される。
これは、種々のコンピュータソフトウェアにより計算できる。たとえば、R(※6)では、以下のスクリプトにて計算可能である。
中間解析(グループ逐次デザイン(※7))事前に計算された症例数に達するまで試験を継続するというのが通常のランダム化比較試験のデザインである。しかし、そのデザインでは、治療効果があるものは早く市場に出し、効果のないものは早く中止すべきという社会的要請に答えられない。また、サンプルサイズ計算に必要な効果の大きさ(エフェクトサイズ)を正確に見積もることは難しく、長期間の試験におけるエフェクトサイズの誤った見積りは深刻である。したがって、試験を途中で終了できる、あるいはデザインを変更できるグループ逐次デザインは重要である。Pocockの方法、O'Brien-Flemingの方法、α消費関数(Pocock型、O'Brien-Fleming型)など、いくつかの方法が存在する。 α消費関数(※8)PocockやO'Brien-Flemingの方法では、検定の回数や検定にかかわる対象者数をあらかじめ決めておかねばならない。この場合、途中で重要な傾向が判明し、予定していなかった検定を行わねばならない事態に対応できない。この問題を解決するために開発されたのがα消費関数を用いる方法である。中間解析の時点で、中止基準となるαは、関数の種類(Pocock型とO'Brien-Fleming型)とそれまでの中間解析の回数によって決定される。この方法を用いれば、中間解析の回数も解析に用いる症例数も開始時点で決定しておく必要はない。ただし、中間解析を行うたびに、中止基準は厳しくなっていく。α消費関数を使った中止基準の計算はR(※6)のldboundsパッケージにより可能である。
|
||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
| RAISE 研究班 厚生労働省医療技術実用化総合研究事業 重症川崎病患者に対する免疫グロブリン・ステロイド初期併用投与の効果を検討する前方視的無作為化比較試験 |
||||||||||||||||||||||||||||||||